بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله تعالى وبركاته
حل أسئلة 3-5 درس مولات المركبات – المول.
نبدأ على بركة الله ...
مسائل تدريبية
29. يستعمل كلوريد الخارصين ZnCl2 بوصفـه سبيكة لحـام لربط فلزيـن معا، احسب عدد مولات أيونات-CI في mol 2.50 من ZnCl2.
الحل:
كل مول من كلوريد الخارصين يحتوي على 2 مول من أيونات الكلور السالب.
2.5 مول من كلوريد الخارصين = 2.5 × 2 = 4.5 مول من أيونات الكلور السالب.
30. تعتمـد النباتات والحيوانات عـلى سـكر الجلوكوز C6H12O6- بوصفه مصدراً للطاقة.
الحل:
احسب عدد مولات كل عنصر في 1.25 mol من الجلوكوز.
1 مول من جزئ الجلوكوز يحتوي على 6 مولات من الكربون، 12 مول من الهيدروجين،6 مولات من الأكسجين.
عدد مولات الكربون في 1.25 من الجلوكوز= 6 × 1.25 = 7.5مول.
عدد مولات الهيدروجين في 1.25 من الجلوكوز= 12 × 1.25 = 15 مول.
عدد مولات الأكسجين في 1.25 من الجلوكوز = 6 × 1.25 = 7.5 مول.
31. احسب عدد مولات أيونات الكبريتات الموجودة في 3.00 mol من 3(Fe2 (SO4.
الحل:
1 مول من كبريتات الحديد يحتوي على 3 مولات من أيونات الكبريتات
عدد مولات الكبريتات في 3 مول من كبريتات الحديد = 3 × 3 = 9 مول.
32. ما عدد مولات ذرات الأكسجين الموجودة في 5.00 mol من P2O5؟
الحل:
1 مول من خامس أكسيد الرصاص يحتوي على 5 مولات من الأكسجين.
عدد مولات الأكسجين في 5 مولات من خامس أكسيد الرصاص =
5 × 5 = 25 مول.
33. تحفيز احسب عدد مولات ذرات الهيدروجين في 1.15 × 101 mol من الماء.
الحل:
عدد مولات الهيدروجين في 1 مول من الماء H2O = 2 مول من ذرات الهيدروجين.
عدد مولات الهيدروجين في 101 × 1.15 مول من الماء 2 × 1.15 × 10 = 23 مول من هيدروجين.
34. احسب الكتلة المولية لكل مركب أيوني من المركبات الآتية:
NaOH .a.
CaCl2 .b.
KCH3O2 .c.
الحل:
الكتلة المولية لهيدروكسيد الصوديوم = الكتلة المولية للصوديوم + الكتلة المولية للأكسجين + الكتلة المولية للهيدروجين
= 23 + 16 + 1
= 40 جم.
الكتلة المولية لكلوريد الكالسيوم = الكتلة المولية للكالسيوم + 2 (الكتلة المولية للكلور) = 40 + (2 × 35.5) = 40 + 71 = 111 جم.
الكتلة المولية لـ KC2H3O2 = الكتلة المولية للبوتاسيوم + 2 (الكتلة المولية
للكربون) + 3 (الكتلة المولية للهيدروجين) + 2 (الكتلة المولية للأكسجين) = 39 + 24 + 3 + 32 = 98 جم.
35. احسب الكتلة المولية لكل مركب تساهمي من المركبات الآتية:
C2H5OH .a.
.HCN .b
CCl4 .c.
الحل:
الكتلة المولية للإيثانول = 2 (الكتلة المولية للكربون) + 6 (الكتلة المولية للهيدروجين) + الكتلة المولية للأكسجين = 24 + 6 + 16 = 46 جم.
الكتلة المولية للسيانيد = كتلة المولية للهيدروجين + الكتلة المولية للكربون + الكتلة المولية للنيتروجين = 1 + 12 + 14 = 27 جم.
الكتلة المولية رباعي كلوريد الكربون = 4 (الكتلة المولية للكلور) + الكتلة المولية للكربون = (4 × 35.5) + 12 = 154 جم.
36. تحفيز صنف كلًا من المركبات الآتية بوصفه مركباً جزيئياً أو أيونيًا، ثم احسب كتلته المولية:
a. Sr (NO3)2
b. (NH4)3PO4
c. C12H22O11
الحل:
مركب نترات السترونشيوم مركب أيونياً.
الكتلة المولية للمركب = الكتلة المولية للسترونشيوم + 2 (الكتلة المولية للنترات) = 87.6 + 2 = 211.6 جم.
فوسفات الأمونيوم مركب أيوني.
الكتلة المولية لمركب فوسفات الأمونيوم = 3 (الكتلة المولية للأمونيوم) + الكتلة المولية للفوسفات = 3 (18) + 95 = 149 جم.
مركب السكروز مركب تساهمي.
الكتلة المولية للسكروز = 12 (الكتلة المولية للكربون) + 22 (الكتلة المولية للهيدروجين) + 11 (الكتلة المولية للأكسجين) = 144 +22 + 176 = 342 جم.
37. ما كتلة 3.25 mol من حمض الكبريتيك H2SO4؟
الحل:
كتلة 1 مول من حمض الكبريتيك = 2 (الكتلة المولية للهيدروجين) + الكتلة المولية للكبريت + 4 (الكتلة المولية للأكسجين)
= 2 + 32 + 64 = 98 جم.
كتلة 3.25 مول من حمض الكبريتيك = 98 × 3.25 = 318.5 جم.
38. ما كتلة 4.35 × 10-2 mol من كلوريد الخارصين ZnCl2؟
الحل:
كتلة 1 مول من كلوريد الخارصين = الكتلة المولية للخارصين + 2 (الكتلة المولية للكلوريد) = 65 + 71 = 136 جم.
39. تحفيز اكتب الصيغة الكيميائية لبرمنجنات البوتاسيوم، ثم احسب كتلة 2.55 mol منه بالجرامات.
الحل:
الصيغة الكيميائية KMnO4
1 مول من برمينجات البوتاسيوم = الكتلة المولية للبوتاسيوم + الكتلة المولية للمنجنيز + 4 (الكتلة المولية للأكسجين) = 39 + 55 + 64 = 158 جم.
40. احسب عدد المولات لكل من المركبات الآتية:
a. 22.6 g من نترات الفضة AgNO3.
b. 6.5 g من كبريتات الخارصين ZnSO4.
الحل:
a. كتلة 1 مول من نترات الفضة =
كتلة الفضة + كتلة النيتروجين + 3 (كتلة الأكسجين)
= 107.8 + 14 + 48 = 169.8 جم.
1 مول = 169.8 جم
عدد مول؟ = 22.6 جم
عدد المولات = الكتلة ÷ كتلة المول الواحد
= 169.8 ÷ 22.6 = 0.13 مول.
b. كتلة 1 مول من كبريتات الخارصين =
الكتلة المولية للخارصين + الكتلة المولية للكبريت + 4 (الكتلة المولية للأكسجين)
= 65.4 + 32 + 64 = 161.4 جم
1 مول = 161.4 جم
عدد مول؟ = 6.5 جم
عدد المولات = الكتلة ÷ كتلة المول الواحد
= 6.5 ÷ 161.4 = 0.04 مول
41. تحفيز صنف كلا من المركبين الآتيين إلى أيوني أو جزيئي، ثم حول الكتل المعطاة إلى مولات:
a. 2.5 kg من أكسيد الحديد Fe2O3 III.
b. 25.4 mg من كلوريد الرصاص PbCl4 IV.
الحل:
أكسيد الحديد مركب تساهمي
1 مول من الأكسيد = 2 (كتلة الحديد) + 3 (كتلة الأكسجين)
= 111.6 + 48 = 159.6 جم.
1 مول = 159.6
عدد مول؟ = 2500 جم (نحول للجرام بالضرب في 1000)
عدد المولات = الكتلة ÷ كتلة المول الواحد
= 159.6 ÷ 2500
= 15.66 مول.
كلوريد الرصاص مركب تساهمي
1 مول من كلوريد الرصاص = كتلة الرصاص + 4 (كتلة الكلور)
= 207.2 + 142 = 349.2 جم.
1 مول = 349.2
عدد مول؟ = 0.0254 (نحول لجرام بالقسمة على 1000)
عدد المولات = الكتلة ÷ كتلة المول الواحد
= 0.0254 ÷ 349.2 = 0.00007 مول.
42. يستعمل الإيثانول C2H5OH مصدرا للوقود، ويخلط أحيانا مع الجازولين. إذا كان لديك عينة من الإيثانول كتلتها g45.6 فأوجد:
a. عدد ذرات الكربون الموجودة فيها.
b. عدد ذرات الهيدروجين الموجودة فيها.
c. عدد ذرات الأكسجين الموجودة فيها.
الحل:
الكتلة المولية للإيثانول = 2 (الكتلة المولية للكربون) + 6 (الكتلة المولية للهيدروجين) + الكتلة المولية للأكسجين
= 24 + 6 + 16 = 46 جم.
عدد مول؟ = 45.6 جم.
1 مول = 46 جم.
يمكن اعتبار كتلة العينة = كتلة 1مول (للتخفيف)
عدد مولات الكربون في 1 مول من الايثانول = 2 مول.
عدد مولات الهيدروجين في 1 مول من الايثانول = 6 مولات.
عدد مولات الأكسجين في 1 مول من الإيثانول = 1 مول.
عدد ذرات الكربون في العينة الموجودة (عينة 1 مول من الإيثانول)
= 1023 × 6.02 × 2
= 1023 × 12.04 ذرة كربون.
عدد ذرات الهيدروجين في العينة الموجودة (عينة 1 مول من الإيثانول)
= 1023 × 6.02 × 6
= 1023 × 36.12 ذرة هيدروجين.
عدد ذرات الأكسجين في العينة الموجودة (عينة 1 مول من الإيثانول)
= 1023 × 6.02 × 1
= 1023 × 6.02 ذرة أكسجين.
43. عينة من كبريتيت الصوديوم Na2SO3 كتلتها 2.25g. أوجد:
a. عدد أيونات + Na الموجودة فيها.
b. عدد أيونات -SO3 2 الموجودة فيها.
c. الكتلة بالجرامات لوحدة صيغة واحدة من Na2SO3 في العينة.
الحل:
نحدد الكتلة المولية لكبريتيت الصوديوم
الكتلة المولية لكبريتيت الصوديوم = 2 (الكتلة المولية للصوديوم) + (الكتلة المولية للكبريت) + 3
الكتلة المولية للأكسجين = 2(23) + 32 + 3(16) = 126 جم.
يجب علينا حساب عدد المولات الموجودة في الكتلة المعطاة وهي 2.25 جم.
1 مول = 126 جم.
عدد مول؟ = 2.25 جم.
عدد المولات في الكتلة المعطاة = الكتلة ÷ كتلة المول الواحد
= 2.25 ÷ 126 = 0.017 مول
يجب معرفة عدد مولات الصوديوم وعدد مولات مجموعة الكبريتات في المول الواحد من كبريتيت الصوديوم
عدد مولات الصوديوم في المركب = 2 مول
عدد مولات مجموعة الكبريتات = 1 مول
تحديد عدد أيونات الصوديوم في 0.017 مول والذي كتلته 2.25 جم.
عدد أيونات الصوديوم = 2 × 0.017 ×(1023×6.02)
= 1022 × 2.04 أيون صوديوم.
عدد أيونات مجموعة الكبريتات = 1 × 0.017 ×(1023 × 6.02)
= 1023 × 0.102 أيون كبريتات.
الكتلة المولية لكبريتيت الصوديوم = 2 (الكتلة المولية للصوديوم) + (الكتلة المولية للكبريت) + 3 الكتلة المولية للأكسجين
= 2 (23) + 32 + 3 (16) = 126 جم لكل مول يحتوي على عدد أفوجادروا من الذرات
كتلة ذرة واحدة = كتلة المول كله ÷ (1023 × 6.02)
= 126 ÷ (1023 × 6.02)
= 1023 × 4.31 جم
44. عينة من ثاني أكسيد الكربون CO2 كتلتها 52.0g أوجد:
a. عدد ذرات الكربون الموجودة فيها.
b. عدد ذرات الأكسجين الموجودة فيها.
c. كتلة جزيء واحد من CO2 بالجرامات.
الحل:
a.
يجب حساب الكتلة المولية لثاني أكسيد الكربون لتحديد عدد المولات في العينة.
1 مول من ثاني أكسيد الكربون على 1 مول من الكربون + 2 مول من الأكسجين.
الكتلة المولية للمركب = الكتلة المولية للكربون + 2 (الكتلة المولية للأكسجين) = 12 + 32 = 44 جرام / مول.
نحدد عدد المولات في عينة كتلتها 52 جم من المركب.
عدد المولات = كتلة العينة ÷ كتلة المول = 44 ÷ 52 = 1.18 مول.
عدد ذرات الكربون في مول واحد من ثاني أكسيد الكربون = 1023×6.02 ذرة كربون.
عدد ذرات الكربون في 1.18 مول = 1023×6.02 × 1.18
= 1023 × 7.10 ذرة كربون.
b.
عدد ذرات الأكسجين في مول واحد من ثاني أكسيد الكربون
= 1023 × 6.02 × 2 ذرة أكسجين.
عدد ذرات الأكسجين في 1.18 مول = 1023 × 6.02 × 1.18 × 2
= 1023 × 14.20 ذرة أكسجين.
نلاحظ أن عدد ذرات الأكسجين هي ضعف عدد ذرات الكربون لأن عدد مولات الأكسجين في العينة ضعف عدد مولات الكربون.
c.
كتلة جزئ واحد من ثاني أكسيد الكربون = الكتلة المولية للمركب = الكتلة المولية للكربون + 2 (الكتلة المولية للأكسجين) = 12 + 32 = 44 جرام.
45. ما كتلة كلوريد الصوديوم NaCl التي تحتوي على 1024 × 4.59 وحدة صيغة؟
الحل:
عدد الصيغ في العينة = 1024 × 4.59
نحدد عدد المولات الموجودة في العينة
1 مول يحتوي على 1023 × 6.02
عدد المولات؟ = 1024 × 4.52
عدد المولات = عدد الصيغ ÷ عدد الصيغ في المول الواحد
= (1023 × 6.02) ÷ (1024 × 4.52)
= 7.5 مول.
الكتلة المولية بالجرام لكل واحد مول = الكتلة المولية للصوديوم + الكتلة المولية للكلور
= 23 + 35.5 = 58.5 جرام / مول.
كتلة 1 مول = 58.5 جم
كتلة 7.5 مول =؟
كتلة 7.5 مول = 7.5 × 58.5 = 438.75 جم.
46. تحفيز عينة من كرومات الفضة كتلتها 25.8 g:
a. اكتب صيغة كرومات الفضة.
b. عدد الأيونات الموجبة فيها.
c. عدد الأيونات السالبة فيها.
d. مقدار الكتلة بالجرامات لوحدة صيغة واحدة منها.
الحل:
a.
صيغة كرومات الفضة = Ag2CrO4
b.
عدد المولات فـ العينة = مولين من الفضة ومول من الكروم، عدد المولات السالبة = 4 من الأكسجين.
كتلة العينة = 25.8 جم.
الكتلة المولية لكرومات الفضة = 2 (الكتلة المولية للفضة) + الكتلة المولية للكروم + 4 (الكتلة المولية للأكسجين)
= 2 (107.8) + 52 + 4 (16) = 331.6 جم.
1 مول = 331.6 جم.
عدد مول ؟ = 25.8 جم.
عدد المولات = الكتلة ÷ كتلة المول الواحد = 331.6 ÷ 25.8 =
0.077 مول.
عدد مولات الأيونات الموجبة = 3 مولات موجبة.
عدد مولات الأيونات الموجبة = 1023 × 6.02 × 0.077 × 3 = 1023× 1.4 أيون موجب.
عدد مولات الأيونات السالبة = 4 مولات من الأكسجين.
عدد الأيونات السالبة = 1023 × 6.02 × 0.077 × 3
= 1023 × 1.87 أيون سالب.
1 مول من كرومات الفضة = 1023 × 6.02
صيغة = 331.6 جم
كتلة الصيغة الواحدة = كتلة كرومات الفضة ÷ عدد الصيغ
= (1023 × 6.02) ÷ 331.6 = 10-22 × 5.5 جم.
التقويم 3-5
47. الفكرة الرئيسة صف كيف تحدد الكتلة المولية للمركب؟
الحل:
لتحديد الكتلة المولية لكل مركب نحدد الصيغة الكيميائية له بطريقة صحيحة، نحدد عدد مولات كل عنصر في المركب ومن خلال معرفة عدد المولات كل عنصر حسب عدد المولات وبذلك نحدد الكتلة المولية للمركب.
48. حدد عوامل التحويل المطلوبة للتحويل بين عدد مولات المركب وكتلته.
الحل:
الكتلة المولية ومقلوبها هما عاملا التحويل بين عدد مولات المركب وكتلته.
عدد المولات = الكتلة المعطاة ÷ كتلة المول الواحد.
49. وضح كيف يمكنك أن تحدد عدد الذرات أو الأيونات في كتلة معينة من المركب؟
الحل:
نحدد الكتلة المولية للمركب.
نحدد عدد المولات الموجودة في العينة من خلال معرفة كلا من كتلة العينة والكتلة المولية.
نحدد عدد مولات كل أيون أو ذرة في المركب، مثلا أيون عدد مولاته 1 أو 2 من خلال أعداد التأكسد.
نضرب عدد مولات الأيون في عدد مولات المركب في عدد أفوجادروا وبذلك نحدد عدد الذرات أو الأيونات.
50. طبق ما عدد مولات ذرات كل من O,C,K في مول واحد من K2C2O4؟
الحل:
عدد مولات البوتاسيوم K =2.
عدد مولات الكربون C = 2.
عدد مولات الأكسجين O = 4.
51.احسب الكتلة المولية لبروميد الماغنسيوم MgBr2.
الحل:
يجب أن ندقق في الصيغة الكيميائية للمركب لتحديد عدد مولات كل أيون فيه وهنا بروميد الماغنسيوم يتكون من نوعين هما أيون البروميد وأيون الماغنسيوم.
عدد مولات أيون البروميد = 2 مول
عدد مولات أيون الماغنسيوم = 1
الكتلة المولية لبروميد الماغنسيوم = الكتلة المولية للماغنسيوم + 2 (الكتلة
المولية للبروم) = 24 + 2 (78) = 180 جم / مول.
52. احسب ما عدد مولات Ca2+ الموجودة في 1000 mg من CaCO3؟
الحل:
نحدد الكتلة المولية للمركب = الكتلة المولية للكالسيوم + الكتلة المولية للكربون + 3 (الكتلة المولية للأكسجين) = 40 + 12 + 3 (16)
= 100 جم / مول
كتلة المول الواحد = 100 جم
كتلة مولات؟ = 1000 ملجم
= 1 جم (نحول لجرام بالقسمة على 1000)
عدد المولات = الكتلة المعطاة / كتلة المول الواحد = 1 / 100 = 0.01 مول.
عدد مولات أيون الكالسيوم لمول واحد من المركب = 1 مول
عدد مولات الكالسيوم في عينة كتلتها 1 جم = 0.01 × 1 = 0.01 مول.
يجب أن نميز بين عدد مولات الأيون وعدد الأيونات، في حالة طلب عدد
الأيونات نضرب عدد المولات في عدد أفوجادروا.
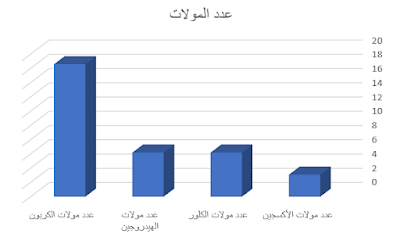
53. صمم رسماً بيانياً بالأعمدة يظهر عدد مولات كل عنصر موجود في 500 g من الدايوكسين (C12H4Cl4O2) الشديد السمية؟
الحل:
يجب أن نحسب الكتلة المولية للدايوكسين لمعرفة عدد المولات الموجودة في 500 جم منه.
الكتلة المولية للدايوكسين = 12 (الكتلة المولية للكربون) + 4 (الكتلة المولية للهيدروجين) + 4 (الكلية المولية للكلور) + 2 (الكتلة المولية للأكسجين)
= 12 (12) + 4 (1) + 4 (35.5) + 2 (16)
= 144 + 4 + 142 + 32 = 322 جم / مول.
يجب أن نحسب عدد المولات الموجودة في الكتلة المعطاة
عدد المولات = الكتلة / كتلة المول الواحد = 322 / 500 = 1.55 مول
عدد المولات في كتلة 500 جم من الدايوكسين = 1.55 مول
نحدد عدد مولات كل عنصر موجود في العينة.
أولا عدد مولات العناصر في المول الواحد من المركب هي
الكربون = 12، الهيدروجين= 4، الكلور = 4، الأكسجين = 2.
عدد مولات الكربون في 1.55 مول من المركب = 12 × 1 × 1.55 = 18.6 مول كربون.
عدد مولات الهيدروجين في 1.55 مول من المركب = 4 × 1 × 1.55 = 6.2 مول هيدروجين.
عدد مولات الكلور في 1.55 مول من المركب = 4 × 1 × 1.55 = 6.2 مول كلور.
عدد مولات الأكسجين في 1.55 مول من المركب = 1.55 × 1 × 1.55 = 3.1 مول أكسجين.
نلاحظ تساوي عدد مولات الكلور والهيدروجين لأن كل منهما
يساهم بعدد متساو من المولات في المركب.
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"








ليست هناك تعليقات:
إرسال تعليق