بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته
حل أسئلة الفصل الثالث – تركيب المادة.
نبدأ على بركة الله ...
1 – 3
إتقان المفاهيم
30. من أول من اقتراح مفهوم أن المادة مكونة من جسيمات صغيرة لا يمكن تجزئتها؟
الحل:
الفيلسوف ديموقريطوس.
31. من العالم الذي اعتبر عمله بداية تطور النظرية الذرية الحديثة؟
الحل:
نظرية العالم دالتون.
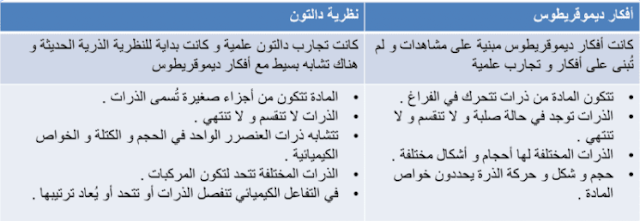
32. ميز بين أفكار ديموقريطوس ونظرية دالتون الذرية.
33. الأفكار والطرائق العلمية هل كان اقتراح ديمويطوس حول وجود الذرات معتمداً على طرائق وأفكار علمية؟ اشرح.
الحل:
لم تكن أفكار ديموقريطوس معتمدة على طرائق وأفكار علمية ولم يكن يعرف التجارب المحددة لتركيب الذرة، ولكن كانت مبنية على خبراته في الحياة.
34. فسر لماذا لم يتمكن ديموقريطوس من إثبات أفكاره تجريبياً.
الحل:
بسبب عدم قدرته على عمل التجارب المحددة لصدق أفكاره لإنعدام الإمكانيات العلمية التي يستند عليها.
35. لماذا اعترض أرسطو على النظرية الذرية؟
الحل:
أعترض على فكرة أن الذرات تتحرك في الفراغ لأنه لا يعتقد بوجود الفراغ.
36. اذكر الأفكار الرئيسة لنظرية دالتون الذرية بلغتك الخاصة. أيها تبين مؤخراً أنه خطأ؟ فسر إجابتك.
الحل:
المادة تتكون من أجزاء صغيرة تسمى الذرات، وهذه الذرات لا تنقسم ولا تتجزأ، ذرات العنصر الواحد متشابه في الحجم والكتلة والخواص، أثناء التفاعل الكيميائي تتحد أو تنفصل الذرات أو يعاد ترتيبها.
37. حفظ الكتلة وضح كيف قدمت لنا نظرية دالتون الذرية شرحاً مقنعاً عن ملاحظاتنا حول حفظ الكتلة في التفاعل الكيميائي؟
الحل:
طبقاً لنظرية دالتون الذرات عند تفاعلها فإنها ترتبط أو تنفصل أو يعاد ترتيبها، ولكنها لا تفنى أو تنقص أو تزيد عددها أو كتلتها أثناء التفاعل الكيميائي، فالذرات لا تنكسر لتكون ذرات جديدة. فعند تفاعل 5 ذرات من مادة كتلتها 4 جم مع 6 ذرات من مادة كتلتها 3 جم فإن الناتج يتكون من 11 ذرة ويكون الكتلة 7 جم إن لم يكن هناك تصاعد مادة. بذلك المادة لا تفنى ولا تستحدث من العدم والتفاعل الكيميائي يحافظ على الكتلة وهو ما ينص عليه قانون حفظ الكتلة. فنظرية دالتون تدعم قانون حفظ الكتلة.
2 – 3
إتقان المفاهيم
38. ما الجسيمات التي توجد في نواة الذرة؟ وما شحنة النواة؟
الحل:
في نواة الذرة يوجد نوعان من الجسيمات هما البروتونات والنيترونات، شحنة البروتونات موجبة أما شحنة النيترونات فهي متعادلة غير مشحونة.
39. كيف كانت الشحنة الكلية موزعة في نموذج طومسون الذري؟
الحل:
الذرة عند طومسون عبارة عن شكل كروي مكون من شحنات موجبة منتظمة التوزيع وينغمس في هذه الشحنة الموجبة إلكترونات منفردة سالبة الشحنة.
40. كيف أثر توزيع الشحنة في نموذج طومسون في جسيمات ألفا التي مرت خلال الذرة؟
الحل:
استخدم طومسون الشحنات الكهربائية والمغناطيسية لتحديد شحنة وكتلة الشحنات المعروفة بأشعة المهبط.
41. رتب مكونات الذرة: النيوترون، الإلكترون، البروتون، تصاعدياً بحسب كتلها.
الحل:
كتلة الإلكترون أقل الجسيمات كتلة وتكون مهملة. ثم بعدها كتلة البروتون والنيترون وتكاد تكون واحدة، ولكن النيترون أكبر قليلاً.
42. سم مكونات الذرة المبينة في الشكل 22 – 3.
الحل:
A. سحابة الإلكترونات.
B. بروتون.
C. نيترون.
43. فسر سبب تعادل الذرات كهربائياً.
الحل:
الذرة تتكون من نواة موجبة الشحنة وإلكترونات سالبة الشحنة وكمية الشحنة من البروتونات في النواة تساوي كمية الشحنة السالبة للإلكترونات التي تدور حول النواة.
44. ما شحنة نواة ذرة العنصر الذي عدده الذري 89؟
الحل:
النواة دائماً موجبة الشحنة نتيجة البروتونات الموجبة وفي هذه الذرة شحنة البروتونات = +89 لأن عددها الذري يساوي 89.
45. ما الجسيمات المسؤولة عن معظم كتلة الذرة؟
الحل:
الجسيمات المسؤولة عن معظم كتلة الذرة هما البروتونات والنيترونات لأن كتلة الإلكترونات قليلة جداً وتكون مهملة.
46. لو كان لديك ميزان يمكنه تحديد كتلة البروتون فما عدد الإلكترونات التي تزن بروتوناً واحداً؟
الحل:
كتلة حوالي 1840 إلكترون تساوي كتلة بروتون واحد طبقاً للكتلة النسبية لهما.
47. أنابيب أشعة المهبط ما الجسيمات المكونة للذرة التي اكتشفها العلماء باستعمال أنابيب أشعة المهبط؟
الحل:
اكتشف طومسون الإلكترون وحدد النسبة بين كتلته وشحنته.
48. ما نتائج التجربة التي أدت إلى استنتاج أن الإلكترون جسيم موجود في جميع المواد؟
الحل:
كانت تجربة أشعة المهبط سبب لاكتشاف الإلكترون، وكانت أشعة المهبط الناتجة لا تتغير بتغير المادة أو الأقطاب أو الغاز الموجود في الأنبوب لذلك أستنتج العلماء أن هذه الجسيمات السالبة (الإلكترونات) موجودة في كل المواد.
الحل:
تنتقل الكهرباء من قطب المهبط إلى المصعد. تنتقل الإلكترونات السالبة من القطب السالب للبطارية للقطب الموجب نتيجة فرق جهد بينهما.
50. وضح باختصار كيف اكتشف رذرفورد النواة؟
الحل:
رذرفورد استخدم جسيمات ألفا موجبة الشحنة لتمر خلال صفيحة رقيقة من الذهب وقارن اتجاه جسيمات ألفا قبل دخولها وبعد المرور على الصفيحة فلاحظ أن هناك انحراف في اتجاه بعض الجسيمات بمقدار قليل وانحراف بمقدار كبير كما أن معظم الجسيمات مرت دون انحراف. من خلال هذه الملاحظات استنتج رذرفورد أن الذرة تتكون من إلكترونات سالبة الشحنة ونواة موجبة الشحنة، وأن معظم الذرة فراغ.
51. انحراف الجسيمات ما الذي سبب انحراف جسيمات ألفا في تجربة رذرفورد؟
الحل:
يحدث نوعان من الانحراف في جسيمات ألفا عند مرورها خلال صفيحة الذهب:
· انحراف بزاوية كبيرة عند مرور جسيم ألفا بالقرب من نواة ذرة الذهب فكأنه سيصطدم بالنواة فينحرف.
· انحراف بزاوية أقل بسبب التنافر بين جسيمات ألفا الموجبة مع شحنة النواة الموجبة. شحنتان موجبتان متشابهتان يحدث بينهما تنافر وانحراف جسم ألفا بعيداً عن الشحنة الموجبة.
52. شحنة أشعة المهبط كيف تم استعمال المجال الكهربائي لتحديد شحنة أشعة (الكاثود) المهبط؟
الحل:
انحرفت أشعة المهبط في اتجاه الصفيحة موجبة الشحنة في المجال الكهربي لذلك فهي سالبة الشحنة لو كانت شحنتها موجبة لتنافرت.
53. وضح ما الذي يبقي الإلكترون في الفراغ المحيط بالنواة؟
الحل:
الإلكترونات سالبة الشحنة والنواة موجبة الشحنة هناك قوة جذب مركزية من النواة للإلكترونات بسبب الاختلاف في الشحنة هذه قوة التجاذب تعادل قوة الطرد المركزية الناتجة من حركة الإلكترونات. يمكن توضيح ذلك بحركة الكواكب حول الشمس فتكون الشمس بمثابة النواة والكواكب هي الإلكترونات.
54. تصوير الذرات ما التقنية المستعملة في تصوير الذرات منفردة؟
الحل:
هناك أكثر من تقنية لتصوير الذرات منفردة ومن هذه التقنيات المجهر الإلكتروني وليس الضوئي. ومن أمثلة المجهر الإلكتروني المجهر الماسح.
55. ما نقاط قوة وضعف نموذج رذرفورد للذرة؟
الحل:
نقاط قوة رذرفورد أوضح أن الذرة بها فراغ وليست مصمتة بالتجارب التي استخدم فيها صفيحة الذهب، أوضح شحنة النواة والإلكترونات وسبب تعادل الذرة كهربيا، ساعد في اكتشاف النواة. أما نقاط الضعف فإنه لم يستطع تفسير كتلة الذرة.
3-3
إتقان المفاهيم
56. فيم تختلف نظائر عنصر ما، وفيم تتشابه؟
الحل:
تختلف النظائر في عدد النيترونات الموجودة في النواة بينما تتشابه في العدد الذري (عدد البروتونات) وعدد الإلكترونات. وتختلف بالتالي في العدد الكتلي فكل عنصر له عدد كتلي خاص به.
57. كيف يرتبط العدد الذري للذرات مع عدد البروتونات، وكذلك مع عدد الإلكترونات؟
الحل:
العدد الذري هو عبارة عن عدد البروتونات داخل النواة = عدد الإلكترونات التي تدور حول النواة.
58. كيف يرتبط العدد الكتلي للذرة مع عدد البروتونات، ومع عدد النيوترونات؟
الحل:
العدد الكتلي = عدد البروتونات + عدد النيترونات داخل النواة.
59. كيف يمكنك تحديد عدد النيوترونات في الذرة معتمداً على العدد الكتلي والعدد الذري؟
الحل:
العدد الكتلي = عدد النيترونات + عدد البروتونات
العدد الذري = عدد البروتونات
عدد النيترونات = العدد الكتلي – العدد الذري
60. ماذا يمثل كل من العدد
المكتوب أعلى رمز عنصر البوتاسيوم والعدد المكتوب في أسفله
الحل:
العدد المكتوب أعلى الرمز هو العدد الكتلي وهو عبارة عن عدد البروتونات + عدد النيترونات، العدد أسفل الرمز هو العدد الذري ويساوي عدد البروتونات وعدد الإلكترونات.
عدد البروتونات = عدد الإلكترونات = العدد الذري = 19
العدد الكتلي = 40
عدد النيترونات = 40 – 19 = 21
61. الوحدات القياسية عرف وحدة الكتل الذرية. ما فوائد تطوير وحدة الكتلة الذرية بوصفها وحدة قياسية للكتلة؟
الحل:
وحدة الكتل الذرية (amu): هي 12/ 1 من كتلة ذرة الكربون -12 أي أن وحدة الكتل الذرية تساوي تقريباً كتلة البروتون أو النيترون. تطوير وحدة الكتلة الذرية يمكن العلماء من تحديد كتلة الذرات بسهولة حيث أن الكتل صغيرة جداً مما يسبب صعوبة في القياس.
62. النظائر هل العناصر الآتية نظائر لعنصر واحد؟ فسر ذلك.
الحل:
نعم هذه العناصر نظائر لعنصر واحد، حيث إنها تتشابه في العدد الذري (عدد البروتونات) = 12 بينما تختلف في العدد الكتلي (عدد النيترونات).
Mg -24 العدد الكتلي 24 وعدد النيترونات = 12
Mg -25 العدد الكتلي = 25 وعدد النيترونات = 13
Mg -26 العدد الكتلي = 26 وعدد النيترونات = 14
63. هل وجود النظائر يناقض نظرية دالتون الذرية؟ وضح ذلك.
الحل:
نعم وجود النظائر يتعارض مع نظرية دالتون، حيث أعتقد دالتون أن ذرات العنصر الواحد متشابهة، ولكن في حالة النظائر يختلف عدد النيترونات من نظير للآخر، كما أعتقد أنه لا يمكن تجزأت العنصر وفي حالة النظائر غير مستقرة تفقد جزء من طاقتها على هيئة إشعاع.
إتقان حل المسائل
64. ما عدد البروتونات وعدد الإلكترونات الموجودة في ذرة عنصر عدده الذري 44؟
الحل:
العدد الذري = 44
عدد البروتونات = عدد الإلكترونات = العدد الذري = 44
65. الكربون C العدد الكتلي لذرة الكربون 12، والعدد الذري لها 6. ما عدد النيوترونات في نواتها؟
الحل:
العدد الكتلي = 12
العدد الذري = عدد البروتونات = 6
عدد النيترونات = العدد الكتلي - عدد البروتونات
= 12 – 6 =6
66. الزئبق Hg يحتوي أحد نظائر الزئبق على 80 بروتوناً و120 نيوتروناً. ما العدد الكتلي لهذا النظير؟
الحل:
العدد الكتلي = عدد البروتونات + عدد النيترونات
= 80 + 120 = 200
67. الزينون Xe لعنصر الزينون نظير عدده الذري 54، ويحتوي على 77 نيوتروناً. ما العدد الكتلي لهذا النظير؟
الحل:
العدد الكتلي = عدد البروتونات + عدد النيترونات
= 54 + 77 = 131
68. إذا احتوت ذرة عنصر ما على 18 إلكتروناً، فما عدد البروتونات الموجودة في نواة ذرة العنصر؟
الحل:
عدد الإلكترونات = 18
العدد الذري = عدد الإلكترونات = عدد البروتونات = 18
69. الكبريت S بين كيف تساوي الكتلة الذرية لعنصر الكبريت 32.065 amu، إذا علمت أن للكبريت أربعة نظائر كما يأتي:
الحل:
يمكن تحديد الكتلة الذرية من خلال معرفة كتلة كل نظير ونسبته في المادة كالاتي:
النظير الأول: اسهام النظير الأول = 31.975 × 0.9502 = 30.3826
النظير الثاني: اسهام النظير الثاني = 32.971 × 0.0075 = 0.2472
النظير الثالث: اسهام النظير الثالث = 33.968 × 0.0421 = 1.4300
النظير الأول: اسهام النظير الأول = 35.967 × 0.0002 = 0.0071
الكتلة الذرية = مجموع اسهامات كل النظائر = 30.3826 + 0.2472 + 1.4300 + 0.0071 = 32.065 amu
بهذه الطريقة يمكن تحدد الكتل الذرية.
70. أكمل الفراغات في الجدول 6-3 الآتي:
الحل:
الكلور -35: العدد الذري = 17، العدد الكتلي = 35، عدد البروتونات = 17، عدد النيترونات = 18، عدد الإلكترونات = 17.
الكلور -37: العدد الذري = 17، العدد الكتلي = 37، عدد البروتونات = 17، عدد النيترونات = 20، عدد الإلكترونات = 20.
الزركونيوم -90: العدد الذري = 40، العدد الكتلي = 90، عدد البروتونات = 40، عدد النيترونات = 50، عدد الإلكترونات = 40.
الزركونيوم -92: العدد الذري = 40، العدد الكتلي = 92، عدد البروتونات = 40، عدد النيترونات = 52، عدد الإلكترونات = 40.
71. ما عدد الإلكترونات والبروتونات والنيوترونات في ذرة كل من العناصر الآتية؟
الحل:
a. عدد البروتونات = 55، عدد النيترونات = العدد الكتلي – عدد البروتونات = 132 – 55 = 77
b. عدد البروتونات = 69، عدد النيترونات = العدد الكتلي – عدد البروتونات =163 – 69 = 94
c. عدد البروتونات = 27، عدد النيترونات = العدد الكتلي – عدد البروتونات = 59 – 27 = 32
d. عدد البروتونات = 30، عدد النيترونات = العدد الكتلي – عدد البروتونات = 70 – 30 = 40
72. مستعيناً بالجدول الدوري، ما عدد الإلكترونات والبروتونات والنيوترونات في ذرة كل من العناصر الآتية؟
a. Ga – 69
b. F – 23
c. Ti – 48
d. Tl – 181
الحل:
Ga – 69:
عدد الإلكترونات = عدد البروتونات = 31
عدد النيترونات = 69 – 30 = 39
F – 23:
عدد الإلكترونات = عدد البروتونات = 9
عدد النيترونات = 23 – 9 = 14
Ti – 48:
عدد الإلكترونات = عدد البروتونات = 22
عدد النيترونات = 48 – 22 = 26
Tl – 181:
عدد الإلكترونات = عدد البروتونات = 81
عدد النيترونات = 181 – 81 = 100
73. مستعيناً بالجدول الدوري، ما عدد البروتونات وعدد الإلكترونات في ذرة كل من العناصر الآتية؟
a. فاناديوم V.
b. منجنيز Mn.
c. إيريديوم Ir.
d. كبريت S.
الحل:
a. عدد البروتونات = عدد الإلكترونات = 23
b. عدد البروتونات = عدد الإلكترونات = 25
c. عدد البروتونات = عدد الإلكترونات = 77
d. عدد البروتونات = عدد الإلكترونات = 16
74. الجاليوم Ga له كتلة ذرية 69.723 amu ، وله نظيران في الطبيعة: جاليوم – 69 وجاليوم – 71، فأي نظير له أكبر نسبة وجود في الطبيعة؟ فسر إجابتك.
الحل:
جاليوم – 69 هو الأكثر وجود بالطبيعة لأن عدده الكتلي هو الأقرب للكتلة الذرية للجاليوم.
الحل:
الفضة لها نظيران، علينا معرفة اسهام كل نظير في الكتلة الذرية كما يلي:
النظير الأول: كتلته = 106.905 نسبته = 52.00%
النظير الثاني: كتلته = 108.905 نسبته = 48%
اسهام النظير الأول = كتلة النظير × النسبة = 106.905 × 0.52 = 55.5906
اسهام النظير الثاني = كتلة النظير × النسبة = 108.905 × 0.48 = 52.2744
كتلة الفضة الذرية = اسهام النظير الأول × اسهام النظير الثاني = 52.2744 + 55.5906 = 107.865 amu
76. استعن بالبيانات المتعلقة بنظائر الكروم الأربعة المبينة في الجدول 7 – 3 لحساب الكتلة الذرية للكروم.
الحل:
اسهام النظير = الكتلة × نسبة النظير
اسهام النظير الأول = 49.946 × 0.0435 = 2.1726
اسهام النظير الثاني = 51.941 × 0.8379 = 43.5213
اسهام النظير الثالث = 52.941 × 0.0950 = 5.0293
اسهام النظير الرابع = 53.939 × 0.036 = 1.9418
الكتلة الذرية للكروم = مجموع اسهامات النظائر الأربعة = 2.1726 + 43.5213 + 5.0293 + 1.9418 = 52.665 amu.
4 – 3
إتقان المفاهيم
77. ما التحلل الإشعاعي؟
الحل:
هو تفاعل نووي تلقائي تصدر فيه الأنوية غير المستقرة طاقة على هيئة اشعاع لتتحول لنواة مستقرة وغالباً ما تتحول لذرة عنصر آخر.
78. ما سبب أن بعض الذرات المشعة؟
الحل:
تكون نواة الذرة غير مستقرة فتصدر اشعاعات لتصبح مستقرة وذلك بسبب نسبة النيترونات الكبيرة أو القليلة بالنسبة للبروتونات.
79. ناقش كيف تصل الذرات المشعة إلى حالة الاستقرار؟
الحل:
الذرات المشعة هي ذرات غير مستقرة تحاول الوصول إلى الاستقرار عن طريق فقد الطاقة بالإشعاع، تصدر نواة الذرة جسيمات مشعة مثل جسيما ألفا وبيتا وعادة ما تتحول من عنصر إلى عنصر آخر. يعتمد استقرار النواة على نسبة وجود النيترونات بالنسبة للبروتونات.
80. عرف جسيم ألفا، وجسيم بيتا، وجسيم جاما.
الحل:
· جسيم ألفا هو جسيم مشحون بشحنة موجبة ثنائية يحتوي على بروتين ونيترون وهو يعادل نواة جسيم هيليوم -4، جسيمات تنجذب للجسيمات السالبة.
· جسيم بيتا هو جسيم سالب الشحنة أحادي وهو سريع الحركة يعادل إلكترون، ولكن مصدره النواة وليس السحابة الإلكترونية، ينجذب للجسيمات الموجبة.
· جسيم جاما جسيمات ذات طاقة وسرعة عالية، متعددة الشحنة فلا تتأثر بالمجال الكهربي، ليس لها كتلة وتصاحب دائماً جسيمات ألفا وبيتا وهي مسؤولة عن فقد معظم الطاقة.
81. اكتب الرموز المستعملة للتعبير عن إشعاعات كل من ألفا، وبيتا، وجاما.
الحل:
82. ما نوع التفاعل الذي يتضمن تغيراً في نواة الذرة؟
الحل:
التفاعل النووي هو الذي يتضمن تغير في نواة الذرة وقد تتحول لعنصر آخر.
83. إصدار الإشعاعات ما التغير الذي يحدث في العدد الكتلي عندما تصدر ذرة مشعة: جسيمات ألفا، جسيمات بيتا، أشعة جاما؟
الحل:
· جسيم ألفا يؤدي إلى نقص العدد الكتلي بمقدار 4 (2 بروتون + 2 نيترون).
· جسيم بيتا لا يؤثر في العدد الكتلي لأنه يحدث نقص في واحد من النيترونات يصاحبه زيادة في بروتون واحد لذلك نقص النيترون يعوضه زيادة البروتون فلا يقل العدد الكتلي.
· جسيم جاما لا يتغير فيه العدد الكتلي لأنه غير مشحون وليس له كتلة، ولكن يصاحبه دائما جسيم ألفا أو بيتا وهما اللذان يؤثران على الذرة.
84. ما العامل الرئيس في تحديد ما إذا كانت نواة العنصر مستقرة أو غير مستقرة؟
الحل:
العامل الرئيسي في استقرار الذرة هو وجود النيترونات في النواة بنسبة كبيرة أو قليلة بالنسبة للبروتون. فتزيد طاقة الذرة وتحاول الذرة الاستقرار بالإشعاع.
85. اشرح كيف يرتبط فقدان الطاقة والاستقرار النووي بالتحلل الإشعاعي؟
الحل:
الذرة غير المستقرة تفقد جزء من طاقتها بالتحلل الإشعاعي فتصدر جسيمات ألفا وبيتا ويؤدي ذلك لظهور أنوية مستقرة.
86. اشرح ما يجب أن يحدث قبل أن تتوقف ذرة مشعة عن التحلل الإشعاعي؟
الحل:
قبل أن تتوقف نواة ذرة عن الإشعاع هي تحدد نسبة النيترونات والبروتونات داخلها حتى تصل إلى استقرار ثابت.
87. البورون – 10 يشع جسيمات ألفا، ويشع السيزيوم – 137 جسيمات بيتا. اكتب معادلة نووية موزونة لكل تحلل إشعاعي.

البورون -10 يشع جسيم ألفا (يحتوي على 2 بروتون و2 نيترون) فيؤدي إلى نقص العدد الكتلي بمقدار 4 والعدد الذري بمقدار 2 لينتج ذرة جديدة هي الليثوم -6.
السيزيوم -137 يشع جسيم بيتا (إلكترون سالب أحادي الشحنة) فلا يؤثر على العدد الكتلي، ولكن يؤدي إلى زيادة عدد البروتونات بمقدار 1 لينتج ذرة جديدة هي البريليوم -137.
مراجعة عامة
88. ما الخطأ في نظرية دالتون الذرية؟ وما المكونات الرئيسة للذرة؟
الحل:
كانت نظرية دالتون نظرية عظيمة وكانت بداية لتطور النظرية الذرية الحديثة، ولكن كان لها عدة أخطاء منها:
· اعتبر أنه من المستحيل تجزأ الذرة، ولكن تم فصل الإلكترونات.
· تتشابه ذرات العنصر الواحد، ولكن هناك نظائر للعنصر الواحد ويمكن أن تختلف في الكتلة وبعض الخواص.
· أن الذرة معظمها فراغ وليست مصمتة.
89. أنبوب أشعة المهبط صف أنبوب أشعة المهبط، وكيف يعمل؟
الحل:
هي أنبوبة استخدمها العلماء للتعرف على مكونات الذرة وكانت بداية لاختراع التلفاز، هي عبارة عن أنبوبة زجاجية مفرغة من الهواء يمر بها تيار كهربي وتحتوي على أقطاب معدنية على طرفيها، قطب المهبط موصل بالطرف السالب وقطبها المصعد موصل بالقطب الموجب. تنتقل الكهرباء خلال الأنبوب نتيجة لفرق الجهد وتمر أشعة المهبط ويتم دراسة تأثير المجال المغناطيسي والكهربي خلالها.
90. الجسيمات المكونة للذرة وضح كيف حدد طومسون نسبة شحنة الإلكترون إلى كتلته؟ وكيف أدى ذلك إلى استنتاج أن الذرات مكونة من جسيمات ذرية؟
الحل:
قام العالم طومسون بسلسة من التجارب العلمية لتحديد كتلة الإلكترون حيث قاس تأثير المجال المغناطيسي والكهربي على هذه الأشعة ثم قارن النسب بنسب أخرى معروفة وبذلك حدد كتلة الإلكترون. واستنتج أنها أقل من كتلة ذرة الهيدروجين أصغر الذرات.
91. تجربة رذرفورد كيف اختلفت نتائج تجربة رذرفورد في صفيحة الذهب عن النتائج التي توقعها؟
الحل:
بالاعتماد على النظريات التي تسبق رذرفورد توقع مرور جسيمات ألفا وأن كمية قليلة من جسيمات ألفا سوف تنحرف عند اصطدامها بالإلكترون لأن الشحنة الموجبة موزعة بانتظام في صفيحة الذهب، ولكن حدث غير ذلك لأن هناك جسيمات ألفا انحرفت بزاوية كبيرة ونسبة انحرفت بزاوية صغيرة وبذلك استنتج ان النواة موجبة الشحنة وأن معظم كتلة الذرة موجودة في النواة.
92. إذا احتوت ذرة متعادلة على 12 بروتوناً فكم إلكتروناً في هذه الذرة؟ فسر إجابتك.
الحل:
عدد البروتونات = ١٢ العدد الذري = عدد الإلكترونات = ۱۲ لأن الذرة متعادلة كهربيا عدد البروتونات الموجبة = عدد الإلكترونات السالبة.
93. إذا احتوت نواة ذرة على 92 بروتوناً، والعدد الكتلي لها 235، فما عدد النيوترونات في نواة هذه الذرة؟ وما الرمز الكيميائي لها؟
الحل:
عدد البروتونات = 92
العدد الكتلي = عدد البروتونات + عدد الإلكترونات =235
عدد النيترونات = 235 – 92 = 143
الرمز الكيميائي:
94. مستعيناً بالجدول الدوري،
أكمل الفراغات في الجدول 8 – 3 الآتي:
الحل:
النظير الأول :S العدد الذري 16، عدد الكتلي 32، عدد البروتونات 16، عدد النيترونات 16، عدد الإلكترونات 16.
النظير الثاني Ca: العدد الذري 20، العدد الكتلي 44، عدد البروتونات 20، عدد النيترونات 24، عدد الإلكترونات 20.
النظير الرابع F: العدد الذري 9، العدد الكتلي 19، عدد البروتونات 9، عدد النيترونات 10، عدد الإلكترونات 9.
النظير الخامس Na: العدد الذري 11، العدد الكتلي 24، عدد البروتونات 11، عدد النيترونات 13، عدد الإلكترونات 11.
95. كم مرة يساوي قطر الذرة قطر نواتها؟ وإذا عرفت أن معظم كتلة الذرة يتركز في نواتها، فماذا يمكنك أن تستنتج عن كثافة النواة؟
الحل:
قطر الذرة يعتمد على عدد مدارات الطاقة التي تدور فيها الإلكترونات. أما بالنسبة بالكثافة فتتركز كثافة الذرة في النواة لأن النواة أكبرها في الكتلة.
96. هل شحنة النواة موجبة أم سالبة أم متعادلة؟ وما شحنة الذرة؟
الحل:
النواة موجبة الشحنة لأنها تحتوي على البروتونات موجبة الشحنة ونيترونات متعادلة الشحنة لذلك الشحنة الكلية للنواة موجبة الشحنة. أما الذرة فهي متعادلة الشحنة لأنها تتكون من نواة موجبة الشحنة متساوية مع الشحنة السالبة للإلكترونات.
97. لماذا انحرفت الإلكترونات في أنبوب أشعة المهبط تحت تأثير المجال الكهربائي؟
الحل:
انحرفت الإلكترونات في أنبوب أشعة المهبط تحت تأثير المجال الكهربي لأنها مشحونة شحنة سالبة لذلك انحرف نحو الصفيحة الموجبة.
98. ما مساهمة العالم هنري موزلي في فهمنا الحديث للذرة؟
الحل:
هنري موزلي من أهم علماء الفيزياء وحاصل على جائزة نوبل في الكيمياء. تابع أبحاث رذرفورد الذرية ودرس البطارية الذرية ومؤسس للجدول الدوري وساهم في اكتشاف عناصر جديدة.
99. ما العدد الكتلي للبوتاسيوم – 39؟ وما رمز هذا النظير؟
الحل:
العدد الكتلي للبوتاسيوم -39 هو 39.
الرمز الكيميائي:
100. البورون – 10، والبورون – 11 نظيران موجودان في الطبيعة. فإذا كانت الكتلة الذرية للبورون 10.81 amu. فأي نظير له أعلى نسبة وجود؟
الحل:
البورن -۱۱ هو الأكثر نسبة لأن كتلة البورن الذرية قريبة من كتلة.
101. أشباه الموصلات للسليكون ثلاثة نظائر موجودة في الطبيعة: هي السليكون – 28، والسيلكون – 29، والسليكون – 30. اكتب رمز كل منها.
الحل:
هذه النظائر الثلاثة تتفق في العدد الذري (عدد البروتونات والإلكترونات، ولكنها تختلف في العدد الكتلي)
102. التيتانيوم استعن بالجدول 9 – 3 الآتي لحساب الكتلة الذرية للتيتانيوم.

الحل:
· جب علينا معرفة اسهام كل نظير في الكتلة الذرية وذلك من خلال القانون: الكتلة X النسبة
· اسهام التيتانيوم 46 = 3.6762 = 0.08 × 45.953
· اسهام التيتانيوم 47 = 3.4274 = 0.073 × 46.952
· اسهام التيتانيوم 48 = 35.385 = 0.738 × 47.948
· اسهام التيتانيوم 49 = 2.6921 = 0.055 × 48.948
· اسهام التيتانيوم 50 = 1.9978 = 0.040 × 49.945
· الكتلة الذرية للتيتانيوم = مجموع اسهام كل العناصر = 35.385+ 2.6921 + 1.9978 +3.6762 + 3.4274
= 47.1785
103. صف كيف يؤثر كل نوع من الإشعاعات في العدد الذري والعدد الكتلي للذرة؟
الحل:
· جسيم ألفا يحتوي على بروتونين ونيترونين، عند إشعاع جسيم ألفا واحد من الذرة يؤدي إلى نقص في العدد الذري بمقدار ۲ (العدد الذري عدد البروتونات) ونقص في العدد الكتلي بمقدار 4 (۲ نيترون + ۲ بروتون)
· جسيم بيتا نشأ من تحلل نيترون إلى بروتون وإلكترون فيؤدي إلى زيادة في عدد البروتونات (العدد الذري) لأنه تم إضافة بروتون جديد، ويحدث ثبات في العدد الكتلي لأنه يحدث نقص في عدد النيترونات بمقدار او زيادة في عدد البروتونات بمقدار 1.
· جسیم جاما لا يؤثر على العدد الذري ولا العدد الكتلي لأن ليس له كتلة.
104. الوجود النسبي للنظير يشكل الماغنسيوم حوالي 2% من قشرة الأرض، وله ثلاثة نظائر في الطبيعة. افترض أنك حللت معدناً ما وحصلت على ثلاثة نظائر للماغنسيوم بالنسب الآتية: Mg – 24 (نسبة وجوده 10%)، و Mg – 26 (نسبة وجوده 11%)، فإذا حلل زميلك معدناً مختلفاً يحتوي على الماغنسيوم فهل تتوقع أن يحتوي على النسب نفسها من جميع النظائر؟ فسر إجابتك.
الحل:
نعم هذه العينة التي يحللها زميلي يكون لها نفس النسب لأن نسبة وجود كل نظير تبقى ثابتة.
105. الإشعاع حدد نوعي
الإشعاع المبينين في الشكل 24 – 3 أدناه فسر إجابتك.

الحل:
· الشعاع الذي مر على استقامته دون أن ينحرف ناحية اليمين أو اليسار شعاع متعادل مثل أشعة جاما.
· الشعاع الذي أنجذب نحو الجانب السالب فهو شعاع موجب الشحنة لأنه انجذب للسالب حيث الشحنات المختلفة تتجاذب مثل جسيمات ألفا .
التفكير الناقد
106. كيف تم استعمال الطرائق العلمية لتحديد نموذج الذرة؟ لماذا اعتبر النموذج نظرية؟
الحل:
تم استعمال عدة نماذج وطرق علمية للتعرف على الذرة مثل التعرف على الإلكترون باستخدام اشعة المهبط استخدام صفيحة الذهب للتعرف على النواة، فقد كان لكل عالم طريقة استخدمها للتعرف التدقيق على الذرة واعتبرت كل نموذج نظرية لأنها أثبتت جزء مهم في تركيب الذرة بطريقة علمية.
107. ناقش ما التجربة التي أدت إلى خلاف حول نموذج طومسون للذرة؟ وضح إجابتك.
الحل:
طريقة رذرفورد التي استخدم فيها صفيحة من الذهب وجسيمات ألفا وأثبتت الطريقة أن الذرة تتكون من نواة موجبة الشحنة يتركز فيها كتلة الذرة و إلكترونات سالبة الشحنة تدور حول النواة.
108. طبق أيهما أكبر: عدد المركبات أم عدد العناصر، وعدد العناصر أم عدد النظائر؟ فسر إجابتك.
الحل:
عدد المركبات أكبر لأن كل عنصر له القدرة على تكوين مركبات عديدة مع عناصر أخرى، عدد النظائر أكبر لأن كل عنصر له أكثر من نصير وبذلك يزيد عدد النظائر.
109. حلل لعنصر ثلاثة نظائر في الطبيعة. ما المعلومات الأخرى التي يجب عليك معرفتها لكي تحسب الكتلة الذرية للعنصر؟
الحل:
لحساب الكتلة الذرية لعنصر يجب معرفة كتلة كل نظير ونسبة كل نظير في هذا العنصر. ونحسب الكتلة الذرية من متوسط كتلة النظائر.
110. طبق إذا كان معظم حجم الذرة فراغاً فاشرح لماذا لا يمكنك تمرير يدك خلال جسم صلب؟
الحل:
نعم معظم حجم الذرة فراغ، ولكن في حالة الجسم الصلب تكون المادة مرتبطة ترابط قوي بين الذرات. الصلابة في العنصر نتيجة الروابط الكيميائية والفيزيائية بين الذرات والجزيئات، ولكن لو بالأماكن بتمرير اليد خلال الذرة سوف نستطيع تمرير يدينا، ولكن هذا مستحيل لأن حجم الذرة متناهي الصغر.
111. صمم ارسم نموذجاً حديثاً للذرة، وحدد مكان كل نوع من الجسيمات الذرية المكونة للذرة.
الحل:
الذرة تتكون من:
1- نواة موجبة الشحنة تتمركز فيها معظم كتلة الذرة
2- الكترونات سالبة الشحنة تدور حول النواة في مدارات الطاقة.
3- نواة الذرة تتكون من بروتونات موجبة الشحنة ونيترونات متعادلة الشحنة.
112. طبق للإنديوم In نظيران في الطبيعة وكتلته الذرية 114.818 amu. الإنديوم - 113 كتلته الذرية 112.904 amu، ونسبة وجوده 4.3%. ما كتلة ونسبة وجود النظير الآخر للإنديوم؟
الحل:
كتلة الإنديوم الذرية = 114.818 amu.
نسبة وجود النظير الأول = 4.3%
نسبة وجود النظير الثاني = 100 – 4.3 = 95.7%
الكتلة الذرية للإنديوم = اسهام النظير الأول + اسهام النظير الثاني
اسهام النظير الأول = كتلته × نسبته
= 112.904 × 043.0
= 4.8548
كتلة الإنديوم الذرية = 4.8548+ اسهام النظير الثاني = 114,818
اسهام النظير الثاني = 114.818- 4.8548
=109.9631
اسهام النظير الثاني = الكتلة × النسبة = 109.9631
كتلة النظير الثاني = اسهام النظير / النسبة = 109.9631 / 0.957
= 114.904
113. استنتج متوسط الكتلة للكبريت قريب من العدد الصحيح 32، ومتوسط الكتلة الذرية للكلور 35.435 amu وهذا العدد ليس عدداً صحيحاً. اقترح سبباً محتملاً لهذا الاختلاف.
الحل:
يقترب الكتلة الذرية من العدد الصحيح عندما يكون نسبة نظير معين عالية جدا عن النظائر الأخرى مثل الكبريت، ولكن في حالة أن العنصر له أكثر من نظير عاليين النسبة في الوجود يكون الكتلة الذرية رقم عشري مثل الكلور.
مسألة تحفيز
114. نظائر الماغنسيوم أوجد قيمة العدد الكتلي للنظير الثالث للماغنسيوم، علماً بأن نسبة وجود نظائر الماغنسيوم في الطبيعة كالآتي:
والكتلة الذرية للماغنسيوم 24.305 amu.
الحل:
نسبة وجود العنصر الثالث 11 %.
الكتلة الذرية للماغنسيوم تقترب من النظير الأول لأنه أكثر نسبة، ولكن لا يوجد كتلة لكل نظير يوجد النسب فقط يمكن معرفة العدد الكتلي من خلال الدراسة = ٢٦
مراجعة تراكمية
115. كيف تختلف الملاحظات النوعية عن الملاحظات النوعية عن الملاحظات الكمية؟ أعط مثالاً على كل نوع منهما.
الحل:
الملاحظات النوعية هي الملاحظات التي يمكن وصفها باستخدام الحواس مثل اللون والرائحة وبعض الخواص الفيزيائية أما الملاحظات الكمية فهي ملاحظات رقمية مثل الطول ودرجة الحرارة.
116. صنف المخاليط أدناه إلى مخلوط متجانس، أو مخلوط غير متجانس:
a. ماء مالح.
b. شربة خضار.
c. ذهب عيار 14.
d. خرسانة.
الحل:
a. ماء مالح مخلوط متجانس
b. شربة خضار مخلوط غير متجانس.
c. الذهب مخلوط متجانس
d. الخرسانة مخلوط غير متجانس.
117. أي مما يأتي تغير فيزيائي، وأيها تغير كيميائي؟
a. ماء يغلي.
b. عود ثقاب مشتعل.
c. سكر ذائب في الماء.
d. صوديوم يتفاعل مع الماء.
e. آيس كريم ينصهر.
الحل:
a. ماء يغلي تغير فيزيائي.
b. عود ثقاب مشتعل تغير فيزيائي.
c. سكر ذائب في الماء تغير فيزيائي.
d. صوديوم يتفاعل مع الماء تغير كيميائي.
e. أيس كريم ينصهر تغير فيزيائي.
تقويم إضافي
118. الكتابة في الكيمياء شاشات التلفزيون والكمبيوتر صف كيف تستعمل أشعة المهبط في توليد صور في شاشات أجهزة التلفزيون والكمبيوتر.
الحل:
يعتمد فكرة التلفزيون و الكمبيوتر على جهاز أشعة المهبط لعرض الصور، هذه أنبوبة مفرغة من الهواء بها قطبي المصعد والمهبط و يمر بها تيار كهربي و ينتقل سيل من الإلكترونات من المهبط و تنجذب هذه الإلكترونات للمصعد لأنها تختلف معها في الشحنة و هذا الشعاع من الإلكترونات يسقط على شاشة مطلية بالفوسفور التي تتوهج عندما يسقط عليها الإلكترونات.
119. STM الذرات المنفردة يمكن رؤيتها من خلال جهاز متطور يسمى STM. اكتب تقريراً مختصراً يبين كيف يتم التصوير، وقم بعمل ألبوم للصور المجهرية معتمداً على الكتب، والمجلات، والإنترنت.
الحل:
تتحرك النقطة عبر العينة، ويتفاعل الإلكترون في النقطة مع الإلكترونات من الذرات المجاورة في العينة وهذا التفاعل يسجل إلكترونيا.
أسئلة المستندات
الزركونيوم Zr فلز ذو بريق معدني، لونه أبيض رمادي، وبسبب
مقاومته العالية للتآكل وقلة امتصاص مقطعه العرضي للنيوترونات فإنه يستعمل عادة في
المفاعلات النووية، كما يمكن أيضاً معالجته (إعادة تصنيعه)، فيبدو مثل الألماس،
ويستعمل في المجوهرات.
120. ما العدد الكتلي لكل نظير من نظائر الزركونيوم في الجدول 10-3 أعلاه؟
الحل:
العدد الكتلي للزرکونیوم – 90 = 90
العدد الكتلي للزركونيوم – 91 = 91
العدد الكتلي للزركونيوم – 92 = 92
العدد الكتلي للزركونيوم – 94 = 94
العدد الكتلي للزركونيوم – 96 = 96
121. أوجد عدد البروتونات، وعدد النيوترونات لكل نظير من نظائر الزركونيوم.
الحل:
عدد البروتونات للزركونيوم – 90 = 40
عدد البروتونات للزركونيوم – 91 = 40
عدد البروتونات للزركونيوم – 92 = 40
عدد البروتونات للزركونيوم – 94 = 40
عدد البروتونات للزركونيوم – 96 = 40
عدد النيترونات للزرکونیوم – 90 = 50
عدد النيترونات للزركونيوم – 91 = 51
عدد النيترونات للزركونيوم – 92 = 52
عدد النيترونات للزركونيوم – 94 = 54
عدد النيترونات للزركونيوم – 96 = 56
122. هل يبقى عدد البروتونات أو عدد النيوترونات ثابتاً في جميع النظائر؟ فسر إجابتك.
الحل:
يبقى عدد البروتونات (عدد الإلكترونات أو العدد الذري) ثابت في كل النظائر، ولكن يختلف فقط النيترونات وبالتالي العدد الكتلي من نظير للآخر.
123. توقع أي النظائر له كتلة ذرية أقرب إلى متوسط الكتلة الذرية للزركونيوم، بناء على نسبة وجودها في الجدول أعلاه؟
الحل:
زركونيوم – 90 هو الأقرب إلى متوسط الكتلة الذرية لأنه الأعلى في نسبة وجوده.
124. احسب قيمة متوسط الكتلة الذرية للزركونيوم.
الحل:
تحسب الكتلة الذرية بضرب نسبة وجود كل نظير للعنصر في كتلته الذرية ثم تجمع النواتج.
الكتلة الذرية المتوسطة للزركونيوم =
تم بحمد الله
نستقبل أسئلتكم واستفساراتكم واقتراحاتكم في خانة التعليقات
"نرد على جميع التعليقات"
بالتوفيق للجميع...^-^























ليست هناك تعليقات:
إرسال تعليق